COLEGIO DE BACHILLERES DEL ESTADO DE PUEBLA
ORGANISMO PUBLICO DESCENTRALIZADO
PLANTEL 20, J. A. I. ROMERO VARGAS
QUÍMICA II
BLOQUE III
COMPRENDES LA UTILIDAD DE LOS SISTEMAS DISPERSOS
INTEGRANTES
Integrantes:
Wendy juliana Ortega Avila
Leonardo Rodriguez Zarate
Brian Oswaldo Aguilar Guzmán
Brian Oswaldo Aguilar Guzmán
¿QUE SON LAS SUSTANCIAS PURAS?
Es materia que tiene una composición específica y propiedades específicas. Cada elemento (de la tabla periódica) es una sustancia pura. Cada compuesto puro es una sustancia.
 El término "sustancia" es bastante común y tiende a ser utilizado con diferentes significados en el lenguaje cotidiano. Sin embargo, en el mundo de la ciencia, la sustancia es simplemente una forma pura de la materia. En otras palabras, una sustancia es materia que contiene sólo un tipo de átomo o molécula. Por el contrario, una mezcla contiene una combinación de diferentes átomos o moléculas y por lo tanto se dice que es impuro.
El término "sustancia" es bastante común y tiende a ser utilizado con diferentes significados en el lenguaje cotidiano. Sin embargo, en el mundo de la ciencia, la sustancia es simplemente una forma pura de la materia. En otras palabras, una sustancia es materia que contiene sólo un tipo de átomo o molécula. Por el contrario, una mezcla contiene una combinación de diferentes átomos o moléculas y por lo tanto se dice que es impuro.
Ejemplos de sustancias: hierro es un elemento y por lo tanto es también una sustancia. El metano es un compuesto y por lo tanto es también una sustancia.
Ejemplos de no sustancias: el agua salada no es una sustancia, es una mezcla de dos sustancias , cloruro de sodio y agua. Su composición y por lo tanto sus propiedades no son fijas. La gasolina no es una sustancia, es una mezcla de hidrocarburos y, dependiendo de la composición de la mezcla de gasolina, las propiedades de la gasolina puede variar.
Tipo de materia que está formada por átomos o moléculas todas iguales. A su vez estas se clasifican en sustancias puras simples y compuestos químicos. Para definir estos dos tipos de sustancias puras hay dos formas. Empecemos por la primera.
Sustancias Puras Simples: Son aquellas sustancias puras que no se pueden descomponer en otras más simples. Están formadas por átomos todos iguales o moléculas con átomos iguales. Ojo hay elementos como el oxígeno que si lo miramos por un microscopio está formado todo por átomos de oxígeno iguales, pero agrupados de dos en dos, es decir agrupado en moléculas de O2, pero como los átomos que forman estas moléculas son iguales (oxigeno-oxigeno) se considera sustancia pura simple.
H2O, moléculas todas iguales, y cada molécula estará formada por dos átomos de hidrógeno (H) y uno de oxígeno (O).
¿QUE SON LAS MEZCLA?
 Se le llama mezcla a la combinación de al menos dos sustancias que, juntas, continúan manteniendo sus propiedades y en las que dicha unión no causa ninguna reacción química.Al no producirse alguna reacción química, las sustancias pueden ser separadas a partir de métodos físicos.
Se le llama mezcla a la combinación de al menos dos sustancias que, juntas, continúan manteniendo sus propiedades y en las que dicha unión no causa ninguna reacción química.Al no producirse alguna reacción química, las sustancias pueden ser separadas a partir de métodos físicos.
Se habla de dos clases de mezclas: homogéneas y heterogéneas:
Una mezcla homogénea: Aquellas mezclas que sus componentes no se pueden diferenciar a simple vista. Las mezclas homogéneas de líquidos se conocen con el nombre de disoluciones y están constituidas por un soluto y un disolvente, siendo el primero el que se encuentra en menor proporción y además suele ser el líquido. Por ejemplo, el agua mezclada con sales minerales o con azúcar, el agua sería el disolvente y el azúcar el soluto.
Los siguientes son diez ejemplos de mezclas homogéneas, con las cuales vivimos nuestro día a día:
- Agua con azúcar.
- Agua con sal.
- Vinagre disuelto en agua.
- Cloro disuelto en agua.
- Tinta con agua.
- El aire es una mezcla homogénea, debido a que es la unión de distintos gases como; oxígeno, bióxido de carbono, vapor de agua y otros gases, que no se pueden separar.
- El café (mezcla homogénea de agua, azúcar y café disuelto en ella).
- El agua del mar, al poseer entre sus componentes agua, sal y otros minerales disueltos, se convierte una mezcla homogénea.
- La masa de un pastel es también una mezcla homogénea, ya que al poseer varios ingredientes en su estructura (que no pueden ser separados luego de mezclados) forma parte de este grupo.
- Los desodorantes en aerosol tienen su lugar en este selecto grupo, debido a que son la mezcla de fragancia, gas isobutano y alcohol que se encuentran en un estado líquido y son atomizados gracias al mecanismo de los envases que los contienen. Asimismo, estos componentes no pueden ser separadas por ningún proceso químico.

Mezclas Heterogéneas : Son mezclas todas aquellas sustancias que se encuentran compuestas de dos o más componentes mismos que se encuentran combinados entre sí, pero en donde no existe reacción química entre los componentes y dan como resultado otras sustancias y materiales, cuyos componentes se pueden separar mediante el uso de métodos físicos, como la filtración, decantación y otros. La mezclas pueden hallarse en estados sólido, gaseoso o líquido, como por ejemplo es el caso de las disoluciones y las suspensiones.
ejemplos de mezclas heterogéneas son:
1. Agua y diésel.
2. Agua y gasolina.
3. Agua y gravilla.
4. Agua y aceite.
5. Polvo y aire.
6. Tierra y aserrín.
7. Frijoles y Chícharos.
8. Chicharros y habas.
9. Vinagre y aceite.
10. El agua y arena
11. El arroz con frijoles.
12. Frijoles y canicas
13. Hojarasca y ramitas secas.
14. La arena y piedras de río.
15. La cera y el agua.
16. La fruta en almíbar.
17. La graba y el arena.
18. La mezcla de aceite de oliva y vinagre.
19. La mezcla de cacahuates y pasitas.
20. La mezcla de frijoles, habas y maíces.
MÉTODOS DE SEPARACIÓN
EVAPORACIÓN: Consiste en calentar la mezcla hasta el punto de ebullición de uno de los componentes, y dejarlo hervir hasta que se evapore totalmente. Este método se emplea si no tenemos interés en utilizar el componente evaporado. Los otros componentes quedan en el envase.
DESTILACIÓN SIMPLE: un tipo de destilación donde los vapores producidos son inmediatamente canalizados hacia un condensador, el cual lo refresca y condensa de modo que el destilado no resulta puro. Su composición será idéntica a la composición de los vapores a la presión y temperatura dados.
La destilación sencilla, se usa para separar aquellos líquidos cuyos puntos de ebullición difieren extraordinariamente (en más de 80°C aproximadamente) o para separar líquidos de sólidos no volátiles.
DESTILACIÓN FRACCIONADA: Proceso que se utiliza en la industria, para mezclas simples de dos componentes (como alcohol y agua en los productos de fermentación, u oxígeno y nitrógeno en el aire líquido) y mezclas más complejas como las que se encuentran en el alquitrán de hulla y en el petroleo.
 CROMATOGRAFIA: es una técnica cuya base se encuentra en diferentes grados de absorción, que a nivel superficial, se pueden dar entre diferentes especies químicas. En la cromatografía de gases, la mezcla, disuelta o no, es transportada por la primera especie química sobre la segunda, que se encuentran inmóvil formando un lecho o camino.Ambos materiales utilizarán las fuerzas de atracción disponibles, el fluido (transportados), para trasladarlos hasta el final del camino y el compuesto inmóvil para que se queden adheridos a su superficie.
CROMATOGRAFIA: es una técnica cuya base se encuentra en diferentes grados de absorción, que a nivel superficial, se pueden dar entre diferentes especies químicas. En la cromatografía de gases, la mezcla, disuelta o no, es transportada por la primera especie química sobre la segunda, que se encuentran inmóvil formando un lecho o camino.Ambos materiales utilizarán las fuerzas de atracción disponibles, el fluido (transportados), para trasladarlos hasta el final del camino y el compuesto inmóvil para que se queden adheridos a su superficie.
Leonardo Rodriguez Zarate 2°E
Decantacion
La decantación es una técnica que permite separar un sólido mezclado heterogéneamente con un líquido en el que es insoluble o bien dos líquidos inmiscibles (que no se pueden mezclar homogeneamente) con densidades diferente.
Es ampliamente usado para separar mezclas de tipo heterogéneas que están conformadas por una sustancia sólida y una líquida o bien por dos sustancias líquidas densas.
Debemos destacar que la decantación no se equipara con la sedimentación, ya que en realidad en esta última la que actúa es la gravedad separando a los materiales sólidos del líquido.
filtración
La filtración es un método de separación de mezclas en la cual se separan los sólidos de los líquidos utilizando paredes o capas porosas, cuyos poros dejan pasar el líquido y dejan pasar el líquido y retienen los sólidos.
Podríamos describir a la filtración como un proceso físico que hace que un elemento sea dividido en partes de acuerdo a su grosor o tamaño. Hablamos de un proceso físico porque es un proceso que tiene que ver con el modo en que las partículas interactúan en el ambiente, en el espacio, y no con fórmulas o elementos químicos. De hecho, la filtración también podría ser entendida como un proceso mecánico que no necesita ser estimulado artificialmente mediante el uso de químicos u otro tipo de productos.
La filtración puede darse en muchas acciones básicas y comunes del día a día, por ejemplo cuando se filtra café. Para hacerlo se necesita contar con filtros muy delicados y con poros muy pequeños que sólo permiten el paso del agua y que retienen los granos de café o el café molido, haciendo que aquella agua caliente que es filtrada sea transformada ya en la bebida conocida como café.
centrifugacion
La centrifugación, en definitiva, consiste en el aprovechamiento de la fuerza centrífuga para separar elementos según la densidad o para secar algo. La máquina que suministra la fuerza centrífuga recibe el nombre de centrifugadora.
Lo que hace una centrifugadora es acelerar el proceso de sedimentación o de decantación de las fases de una mezcla. Esto es posible gracias a las diferentes densidades de los componentes. Mediante la centrifugación, de este modo, se puede separar el suero del plasma en la sangre o la pulpa de un jugo (zumo) frutal, por citar dos posibilidades.
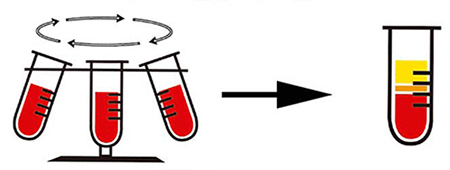 La centrifugación es un método físico por el cual se pueden separar sólidos de líquidos de diferente densidad mediante una fuerza rotativa , la cual imprime a la mezcla con una fuerza mayor que la de la gravedad, provocando la sedimentación de los sólidos o de las partículas de mayor densidad.
La centrifugación es un método físico por el cual se pueden separar sólidos de líquidos de diferente densidad mediante una fuerza rotativa , la cual imprime a la mezcla con una fuerza mayor que la de la gravedad, provocando la sedimentación de los sólidos o de las partículas de mayor densidad.
Cristalización
En términos generales la cristalización responde a un proceso utilizado en química, de solidificación partiendo de un gas, líquido o incluso de una disolución (de iones, átomos o moléculas), que se enlazan hasta lograr formar una red cristalina. También se puede decir, que es la operación por medio de la cual se separa un componente de una disolución líquida para ser transferido a la fase sólida. En otras palabras, es el proceso inverso al de la disolución.
Se puede cristalizar mediante fusión, disolución o sublimación. En química se utiliza mucho la disolución de un sólido para ser purificado, mediante la cristalización, ya que durante el crecimiento del cristal, las moléculas de un mismo tipo, forma y tamaño, se unen y tienden a excluir la presencia de impurezas.
Sublimación
 Es un método de separación de fases donde una de estas debe poder pasar del estado solido al gaseoso que tener que pasar por el liquido ,como lo hace el yodo ,la naftalina y el hierro seco .cuando una de estas fases sublima se separa de la otra .solo se puede usar con sustancias que tengan esta propiedad
Es un método de separación de fases donde una de estas debe poder pasar del estado solido al gaseoso que tener que pasar por el liquido ,como lo hace el yodo ,la naftalina y el hierro seco .cuando una de estas fases sublima se separa de la otra .solo se puede usar con sustancias que tengan esta propiedad
Para la química la sublimación (fenómeno también definido como la volatilizacion )es el procedimiento que se basa en modificar el estado solido de un material por el de estado gaseoso ,sin necesidad de llevarlo al estado liquido .El concepto también permite nombrar al metodo opuesto (el traspaso directo entre el estado gaseoso y el solido ) ,aunque es mas habitual que se hable de sublimación inversa o cristalización
¿Qué son las disoluciones?
Una disolución es una mezcla homogénea a nivel molecular o iónico de dos o más sustancias puras que no reaccionan entre sí, cuyos componentes se encuentran en proporciones variables. También se puede definir como una mezcla homogénea formada por un disolvente y por uno o varios solutos.
Una solución o disolución es una mezcla homogénea en la que se ve involucrado tanto un soluto, como un solvente. El soluto corresponde a la especie química que estén en menor proporción (sin importar si es sólido, líquido o gaseoso), mientras que el solvente, el cual también puede estar presente en los tres estados materiales, es la sustancia mayoritaria de la mezcla. La mayor parte de la Química ocurre en disoluciones, por ejemplo, el aire que respiramos es una disolución gaseosa, el agua potable es una disolución líquida y las aleaciones metálicas (como los objetos de bronce) son disoluciones sólidas.
característica:
- Son mezclas homogenias ;las proporciones relativas de solutos y solvente se mantienen en cualquier cantidad que tomemos de la disolución y no se puede separar por centrifugador ni filtración .
- las propiedades químicas de los componentes de una disolución no se alteran
- Sus componentes se separan por cambios de fases ,como la fusión ,evaporación ,condensación , etc
Clasificacion cualitativa
Disolución diluida : Es aquella en donde la cantidad de soluto que interviene esta en mínima proporción en un volumen determinado .
Disolución concentrada : Tiene una cantidad considerable de soluto en un volumen determinado .
Disolucion instaurada : No tiene la cantidad maxima posible de soluto para una temperatura y presión dadas
Disolucion saturada ; Tiene la mayor cantidad posible de soluto para una temperatura y presión dadas . en ellas existe un equilibrio entre el soluto y el solvente.
Disolucion sobresaturada : Contiene mas soluto del que puede existir en equilibrio a una temperatura y presión dadas .
clasificación cuantitativa:
Las medidas más utilizadas para expresar la concentración de las disoluciones cuantitativas son:
b. Porcentaje masa a Volumen (%m/v)
c. Porcentaje Volumen a Volumen (%v/v)
d. Partes por Millón (ppm
e. Molaridad (M)
f. Normalidad (N)
g. Molalidad (m)
g. Fracción Molar (f molar)
Wendy Juliana Ortega Avila
PRESIÓN OSMÓTICA Y ÓSMOSIS
 Ósmosis es el pasaje del solvente de una solución ya diluida para otra con mayor concentración, a través de una membrana semipermeable.
Ósmosis es el pasaje del solvente de una solución ya diluida para otra con mayor concentración, a través de una membrana semipermeable.
La difusión del líquido para el otro medio de membranas fue observada por primera vez en 1758 por el padre francés Jean Antoine Nollet.
La ósmosis es realizada con el auxilio de una membrana semipermeable que permite el pasaje del solvente y no permite el pasaje del soluto.
La presión osmótica es la presión que debe ser ejercida sobre la solución para evitar la entrada del solvente. Cuanto mayor la presión osmótica, mayor será la tendencia del solvente para entrar en la solución.
La presión osmótica puede ser medida aplicándose una presión externa que bloquee la ósmosis.
COMPOSICIÓN IONICA
es un compuesto químico formado por dos sustancias con una diferencia significativa en sus electronegatividades. Se forma preferentemente cuando metales de los grupos I A y II A se unen con los no metales de los grupos VI A y VII A.
Los compuestos iónicos tienen las propiedades siguientes:
- A temperatura ambiente (25 °C) son sólidos cristalinos, duros y frágiles.
- Poseen altos puntos de fusión.
- En estado anhidro no conducen la corriente eléctrica, pero cuando se calientan al estado de fusión (si no se descomponen), sí la conducen.
- Muchos compuestos iónicos se disuelven en disolventes muy polares (como el agua) y, cuando lo hacen, la solución es eléctricamente conductora.
- Los compuestos covalentes, a diferencia de los iónicos, a temperatura ambiente pueden ser sólidos, líquidos o gases. Generalmente, debido a la naturaleza de enlace, los compuestos covalentes tienen propiedades diferentes a los compuestos iónicos, siempre y cuando no se disocien o ionicen en H2O como es el caso de los ácidos fuertes.

¿QUE SON LOS COLOIDES?
Los coloides son mezclas intermedias entre las soluciones y las mezclas propiamente dichas o burdas. Sus partículas tienen un tamaño comprendido entre 1mμ y 1μ de diámetro. Sus componentes se denominan fase dispersa y medio dispersante.
Según el estado físico en que se encuentren la fase y el medio. Los coloides toman diversas denominaciones.
Según el estado físico en que se encuentren la fase y el medio. Los coloides toman diversas denominaciones.
PROPIEDADES DE LOS COLOIDES
EFECTO TYNDALL
Uno de los hechos característicos que más bien distinguen un coloide (especialmente emulsiones y soles) de un líquido puro o de una solución, es el efecto Tyndall.
Cuando un rayo de luz atraviesa un líquido puro o una solución, la trayectoria del rayo no es visible desde los lados, ya que el tamaño de las partículas es demasiado pequeño para disperar la luz, que pasa entonces libremente. En un coloide, por el contrario, las partículas son lo suficientemente grandes para disperar la luz, y el rayo se hace completamente visible.
EFECTO TYNDALL
Uno de los hechos característicos que más bien distinguen un coloide (especialmente emulsiones y soles) de un líquido puro o de una solución, es el efecto Tyndall.
Cuando un rayo de luz atraviesa un líquido puro o una solución, la trayectoria del rayo no es visible desde los lados, ya que el tamaño de las partículas es demasiado pequeño para disperar la luz, que pasa entonces libremente. En un coloide, por el contrario, las partículas son lo suficientemente grandes para disperar la luz, y el rayo se hace completamente visible.
MOVIMIENTO BROWNIANO.
Cuando un coloide se observa bajo un ultramicroscopio, se nota que las partículas estás animadas de un movimiento rápido, caótico y continúo. Esta actividad cinética se denomina Movimiento Browniano. El movimiento Browniano se debe a un “bombardeo” de las partículas dispersas por partículas del medio y, obviamente, es más intenso cuanto más pequeñas son aquellas partículas
Cuando un coloide se observa bajo un ultramicroscopio, se nota que las partículas estás animadas de un movimiento rápido, caótico y continúo. Esta actividad cinética se denomina Movimiento Browniano. El movimiento Browniano se debe a un “bombardeo” de las partículas dispersas por partículas del medio y, obviamente, es más intenso cuanto más pequeñas son aquellas partículas
DIÁLISIS
Este fenómeno, observado primeramente por Thomas Graham en 1860, consiste en que las partículas coloides son retenidas por membranas semipermeables. Esto diferencia las soluciones de los coloides, ya que las partículas del soluto de aquellas atraviesan fácilmente la membrana.
Este fenómeno, observado primeramente por Thomas Graham en 1860, consiste en que las partículas coloides son retenidas por membranas semipermeables. Esto diferencia las soluciones de los coloides, ya que las partículas del soluto de aquellas atraviesan fácilmente la membrana.
Clasificación
- Coloides Hidrofilacios:
Las proteínas, como la hemoglobina, portadora del oxígeno, forman soles hidrofílicos cuando están suspendidas en disoluciones acuosas de los fluidos biológicos como el plasma sanguíneo.
- Coloides Hidrofobicos:
Los coloides hidrofóbicos no pueden existir sin la presencia de “agentes emulsionantes” o “sustancias emulsivas” que recubran las partículas de la fase dispersa e impidan la coagulación en una fase separada. - Coloides Orgánicos:
Son coloides moleculares producidos naturalmente en reacciones bioquímicas, menos sencillas, que en su mayoría son lio fóbicos, debido a que las sustancias son insolubles en agua. - Coloides Esféricos Y Laminares: representa muchos casos reales. Es la forma que adquieren las partículas esencialmente fluidas, como las gotitas de un líquido dispersas en otro para formar una emulsión.
- Coloides Moleculares y Miselares: Las partículas de los coloides moleculares son macromoléculas sencillas y su estructura es esencialmente la misma que la de estructuras de pequeñas moléculas, los átomos serán unidos por ligaduras químicas verdaderas, a estos coloides moleculares se los llama verdaderos.
- Coloides Intrinsecos:
Son sustancias sólidas que formas dispersiones coloidales al ser puestas en contacto, o calentadas en un medio de dispersión adecuado, y son compuestos de macromoléculas, este tipo de coloides por lo general tiene un carácter liofilo.
- Coloides Extrinsecos: Se le llama a las dispersiones de pequeñas partículas de materiales insolubles de bajo peso molecular. Este tipo de dispersiones son casi invariablemente soles liofobos y deben ser reparados mediante métodos especiales que produzcan partículas de tamaño adecuado.
¿QUE SON LAS SUSPENSIONES?
Suspensión, mezclas heterogeneas formadas por un sólido en polvo o pequeñas partículas no solubles (fase dispersa) que se dispersan en un medio líquido (fase dispersante o dispersora). Cuando uno de los componentes es agua y los otros son sólidos suspendidos en la mezcla, son conocidas como suspensiones mecánicas.
Las suspensiones presentan las siguientes características: la suspension es una manera de disolver todas las caracteristicas de los elementos quimicos de la materia, asi todos los elementos se originan por si solos, hay muchas formas de suspender las mezclas quimicas de los elementos
Sus partículas son mayores que las de las disoluciones y los coloides, lo que permite observarlas a simple vista. Sus partículas se sedimentan si la suspensión se deja en reposo. Los componentes de la suspensión pueden separarse por medio de centrifugación, decantación, filtración y evaporación.




esta bien pero les falto videos y ponerlo un poco atractivo,el blogg habla sobre la contaminacion y cuales son los tipos de contaminacion y el bloque tres habla sobre las mezclas,compuestos etc.
ResponderEliminarGracias pero los vídeos eran obligatorios .
EliminarMuy buen contenido, le falto videos pero interesante :D
ResponderEliminarSería mas completo con ejemplos y uno que otro vídeo, y creo que faltan las fórmulas de la clasificación cuantitativa de las disoluciones. Buen trabajo
ResponderEliminarSería mas completo con ejemplos y uno que otro vídeo, y creo que faltan las fórmulas de la clasificación cuantitativa de las disoluciones. Buen trabajo
ResponderEliminarMuy buena informacion me parecio atractivo su informacion de la contaminacion estoy de acuerdo con todo lo que dice
ResponderEliminarEsta Bien Pero Falto Un Poco Mas De Información
ResponderEliminar